
Back Chloraat Afrikaans كلورات Arabic Хлараты Byelorussian Clorat Catalan Chlorečnany Czech Chlorate German Chlorate English Clorato Spanish کلرات Persian Kloraatti Finnish
CAS # 14866-68-3[1]
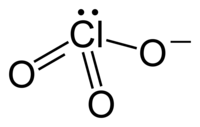
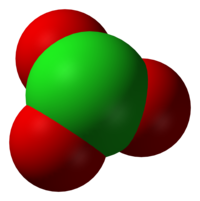
Hloratni anion ima formulu ClO3−. U ovom slučaju, atom hlora je u oksidacijskom stanju +5. Termin hlorat se također može odnositi i na hemijski spoj koji sadrži ovaj anion. Hlorati su soli hlorne kiseline. "Hlorat", kad u zagradama slijedi rimski broj, npr. hlorat (VII), odnosi se na određeni oksijanion hlora. Kao što je predviđeno teorijom odbijanja elektronskih parova valentne ljuske, anioni hlorata imaju trigonalne piramidne strukture.
Hlorati su snažni oksidanti i treba ih držati dalje od organskih materija ili lahko oksidirajućih materijala. Mješavine hloratnih soli s gotovo svim zapaljivim materijalima (šećer, piljevina, drveni ugljen, organska otapala, metali itd.) lahko će brzo sagoriti. Iz ovog razloga su hlorati nekad bili široko korišćeni u pirotehnici, iako je njihova upotreba opala zbog nestabilnosti. Većina pirotehničkih aplikacija koje su ranije koristile hlorate, umjesto toga koriste stabilnije perhlorata .
- ^ "ChemIndustry". Pristupljeno 9. 4. 2014.