
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD
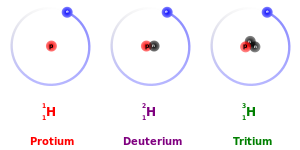

Izotopi su atomi istog elementa[1] koji imaju isti broj protona i elektrona, a različit broj neutrona,imaju ista hemijska ali različita fizička svojstva. Oni stoje na istom mjestu (grčki. ισο [izo] – isti, τόπος [top] – mjesto) u periodnom sistemu elemenata, ali na različitim mjestima na karti nukleotida. Izotopi nekog hemijskog elementa imaju isti atomski broj, a različit maseni broj.
Na primjer, ugljik-12, ugljik-13 i ugljik-14 su tri izotopa elementa ugljika s masenim brojevima 12, 13, odnosno 14. Atomski broj ugljika je 6, što znači da svaki atom ugljika ima 6 protona, tako da su neutronski brojevi ovih izotopa 6, 7, odnosno 8.
Pojam izotop je prvi upotrijebio Frederick Soddy,[2] engleski naučnik, koji je za svoj rad i istraživanje u oblasti izotopa i radioaktivnih elemenata dobio Nobelovu nagradu za hemiju 1921. godine.
U pravilu, svaki prirodni element ima jedan ili više stabilnih izotopa, dok su mu ostali radioaktivni, a samim tim i nestabilni, te se prije ili kasnije raspadaju. Također, postoje hemijski elementi kod kojih su svi izotopi nestabilni, poput urana, plutonija i drugih elemenata.
- ^ "Isotope | Examples & Definition | Britannica". www.britannica.com (jezik: engleski). 31. 10. 2023. Pristupljeno 5. 12. 2023.
- ^ "isotope | Etymology of isotope by etymonline". www.etymonline.com (jezik: engleski). Pristupljeno 5. 12. 2023.