
Back Glisien Afrikaans جلايسين Arabic Aminosirkə turşusu Azerbaijani قلیسین AZB Гліцын Byelorussian Глицин Bulgarian গ্লাইসিন Bengali/Bangla Glicin BS Glicina Catalan Glycin Czech
| Glycin | |
|---|---|
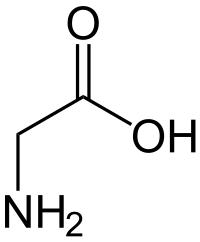
| |
| Generelt | |
| Systematisk navn | aminoethansyre |
| Molekylformel | C2H5NO2 |
| Molmasse | 75,07 |
| CAS nummer | [56-40-6] |
| Egenskaber | |
| Massefylde | 1,595 g/cm³ |
| Smeltepunkt | 232-236 °C |
| Syrestyrkekonstant (pKa) | 2,4 |
| Basestyrkekonstant (pKb) | 9,8 |
| Isoelektrisk punkt (pI) | 6,06 |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Glycin (også Gly eller G) er en α-aminosyre, der findes i næsten alle proteiner. Glycin er den simpleste af aminosyrerne, og den eneste som ikke indeholder et kiralt center, hvorfor den ikke udviser R/S isomeri. Da glycin har en meget lille sidekæde (-H) passer den ind mange steder hvor ingen andre aminosyrer gør, f.eks. i kollagenhelixen.
De fleste proteiner indeholder kun små mængder glycin. En undtagelse er kollagen, i hvilket glycin udgør omtrent en tredjedel.
Glycin fungerer som en hæmmende neurotransmitter i centralnervesystemet, specielt i rygraden, hjernestammen og retina. Når glycinreceptorer aktiveres startes et flux af Cl--ioner ind i neuronen.
Glycin er en ikke-essentiel aminosyre, hvilket betyder at kroppen kan syntetisere det i tilstrækkelige mængder. Ved biosyntesen kan glycin dannes ud fra serin ved fraspaltning af hydroxymethylgruppen (-CH2OH). Denne reaktion varetages af enzymet serinhydroxymethyltransferase.
Glycin er blevet detekteret i støvskyen omkring kometen 67P/Churyumov–Gerasimenko, hvilket viser at kometer har potentiale til at levere kritiske biokemiske molekyler som forudsætning af liv på Jorden.[1]