Back Natriumkarbonaat Afrikaans كربونات الصوديوم Arabic Carbonatu de sodiu AST سودیوم کربونات AZB Натрий карбонаты Bashkir Натриев карбонат Bulgarian সোডিয়াম কার্বনেট Bengali/Bangla Natrij-karbonat BS Carbonat de sodi Catalan Uhličitan sodný Czech
| Natriumkarbonat | |||
|---|---|---|---|
| IUPAC-navn Natriumcarbonat | |||
| Generelt | |||
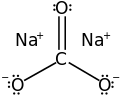
| Molekylformel | Na2CO3 | ||
| Molarmasse | 105.9884 g/mol | ||
| Fremtræden | Hvidt fast, hygroskopisk | ||
| CAS-nummer | |||
| EC-nummer | 207-838-8 | ||
| PubChem | |||
| Kemiske egenskaber | |||
| Massefylde | 2.54 g/cm3 | ||
| Opløselighed i vand | 22 g/100 ml (20 °C) | ||
| Smeltepunkt | 851 °C | ||
| Kogepunkt | 1600 °C | ||
| Basestyrkekonstant (pKb) | 3.67 | ||
| Struktur | |||
| Molekylær form | Trigonal, bipyramidal | ||
| Sikkerhed | |||
| MSDS | S3242 | ||
| EU klassifikation | Lokalirriterende (Xi) | ||
| NFPA 704 | |||
| R-sætninger | R36 | ||
| S-sætninger | S2, S22, S26 | ||
| Flammepunkt | Ikke brændbart | ||
| Beslægtede stoffer | |||
| Andre anioner | Natriumbicarbonat | ||
| Andre kationer | Lithiumcarbonat Kaliumcarbonat Rubidiumcarbonat Cæsiumcarbonat | ||
| Relaterede forbindelser | Ammoniumcarbonat Natriumpercarbonat | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
Soda eller natriumkarbonat er saltet efter kulsyres reaktion med natrium og har den kemiske formel Na2CO3.
Den almindelige soda forhandles som krystalsoda, et produkt, hvor sodaen fremtræder som klare krystaller. Desuden sælges soda ofte som kalcineret Soda. Kalcineret Soda er tre gange stærkere end almindelig soda. Det dannes ved opvarmning af natron, hvorved der fraspaltes vand og kuldioxid:
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Carbonationen CO32- er en middelstærk base med en dissociationskonstant på pK2=10.34.
Soda må ikke forveksles med kaustisk soda (natriumhydroxid), som er en stærkt ætsende base.