
Back مستقبل نووي Arabic Jedarni receptor BS Receptor nuclear Catalan Kernereceptor Danish Πυρηνικός υποδοχέας Greek Nuclear receptor English Receptor nuclear Spanish گیرنده هستهای Persian Tumareseptorit Finnish Récepteur nucléaire French
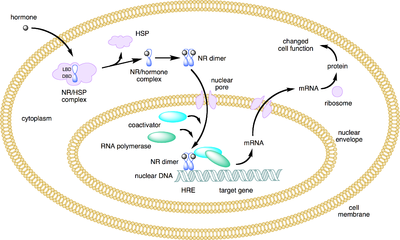

Kernrezeptoren (auch: nukleäre Rezeptoren (NR) oder ligandenaktivierte Transkriptionsfaktoren) sind spezielle Proteine, die im Zellkern von mehrzelligen Tieren vorkommen. Es handelt sich um Transkriptionsfaktoren, die erst durch die Bindung eines Liganden (meist Hormone) in der Lage sind, an DNA zu binden und die Transkription eines oder mehrerer Gene zu unterdrücken oder in Gang zu bringen. Kernrezeptoren sind das Ziel von Hormonen, deren Signal sie umsetzen, indem sie die Produktion bestimmter Proteine beeinflussen. Die Funktion als Transkriptionsfaktor kann nach der Bindung des Liganden durch weitere Bindungspartner modifiziert werden. Beim Menschen sind gerade 48 Kernrezeptoren bekannt,[1] jedoch ist nur bei einem Bruchteil von ihnen der Ligand identifiziert.[2][3]
Die nukleären Rezeptoren können entweder nach ihrem Wirkmechanismus oder nach ihrem Liganden eingeteilt werden. Da sich die phylogenetische Abstammung sowohl in der Aminosäuresequenz als auch im Wirkmechanismus wiederfindet, hat sich die folgende Einteilung etabliert.
Beim Wirkmechanismus wird unterschieden, ob sich der NR beim Zeitpunkt der Bindung des Liganden im Zytosol oder bereits im Zellkern, gebunden an DNA befindet, oder ob die DNA-Bindung als Monomer oder Dimer erfolgt.[3]
- Die klassischen Steroidrezeptoren (Typ 1) wie der Androgenrezeptor befinden sich im inaktiven Zustand an Hitzeschockproteine gebunden im Zytoplasma. Nach Bindung ihres Liganden wird das Hitzeschockprotein abgetrennt, der Rezeptor transloziert in den Zellkern und bindet als Dimer an die DNA, die immer eine palindromische Erkennungssequenz aufweist.
- Die Kernrezeptoren der Typen 2 und 4 befinden sich bei der Ligandenbindung bereits im Zellkern. Sie alle haben ein Zinkfinger-Strukturmotiv, das an die DNA-Basensequenz AGGTCA bindet. Dazu gehören:
- Thyroidhormonrezeptor-ähnliche Rezeptoren wie Peroxisom-Proliferator-aktivierte Rezeptoren oder Vitamin-D-Rezeptor
- Retinoid-X-Rezeptor-ähnliche Rezeptoren
- NGF1-b-ähnlich
- SF1-ähnlich
- GCNF-ähnlich und andere
- ↑ Zhang Z, Burch PE, Cooney AJ, Lanz RB, Pereira FA, Wu J, Gibbs RA, Weinstock G, Wheeler DA: Genomic analysis of the nuclear receptor family: new insights into structure, regulation, and evolution from the rat genome. In: Genome Research. 14. Jahrgang, Nr. 4, April 2004, S. 580–90, doi:10.1101/gr.2160004, PMID 15059999, PMC 383302 (freier Volltext). Vorlage:Cite journal: Der Parameter language wurde bei wahrscheinlich fremdsprachiger Quelle nicht angegeben.
- ↑ GO-Terminus ligand-dependent nuclear receptor activity.
- ↑ a b Detlev Ganten, Klaus Ruckpaul: Molekularmedizinische Grundlagen von Endokrinopathien. Springer, Berlin 2001, ISBN 3-540-67788-7, S. 7 ff.