
Back Amied Afrikaans أميد Arabic Amida AST Амид Bulgarian Amid BS Amida (compost químic) Catalan Amidy Czech Amid Welsh Amide German Αμίδια Greek
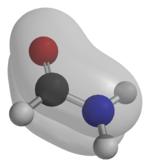
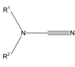
Una amida es un compuesto que se forma conceptual o químicamente por el reemplazo del hidroxilo de un oxácido por un sustituyente amino. En química orgánica, se le denomina por antonomasia como "amida" a las amidas de los ácidos carboxílicos (estrictamente, carboxamida). Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).[1] Por esto su grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
| Formamida (amida del ácido fórmico) |
Amida (carboxamida) (amida de ácido carboxílico) |
Urea o carbamida (amida del ácido carbónico) |
Cianimida (amida del ácido ciánico) |
Hexametilfosforamida (amida hexametilada del ácido fosfórico) |
Sulfamida (amida de ácido sulfúrico) |
Nitramida (amida de ácido nítrico) |
|---|---|---|---|---|---|---|

|

|
|

|
Cuando el grupo amida no es el principal, se nombra usando el prefijo carbamoil:[2]
CH3-CH2-CH(CONH2)-CH2-CH2-COOH → ácido 4-carbamoilhexanoico.
Todas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente[3] y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea,[4] una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon.[5] Las amidas también se utilizan mucho en la industria farmacéutica.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Química para el Acceso a Ciclos Formativos de Grado Superior .e-book.. MAD-Eduforma. ISBN 9788466530453. Consultado el 18 de noviembre de 2017.
- ↑ Finck, Arnold (1988). Fertilizantes y fertilización: fundamentos y métodos para la fertilización de los cultivos. Reverte. ISBN 9788429110104. Consultado el 18 de noviembre de 2017.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 18 de noviembre de 2017.