
Back Kovalente binding Afrikaans Enlace covalent AN رابطة تساهمية Arabic Enllaz covalente AST Kovalent əlaqə Azerbaijani Кавалентная сувязь Byelorussian Ковалентна връзка Bulgarian সমযোজী বন্ধন Bengali/Bangla Kovalentna veza BS Enllaç covalent Catalan
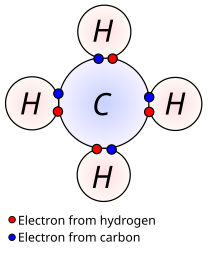
Lotura kobalentea bi atomoren artean elektroi-pareen banaketa oinarritzat hartzen duen lotura kimikoa da. Bi atomoen artean, lotura kobalentea hau osatzen duten atomoek zortzikotearen araua betetzeko ematen da. Hau honela izan dadin, loturan atomo bakoitzak bere balentzia orbitaleandauden elektroiak partekatzen dituzte. Lotura kobalentea eratzeko, bi atomoen arteko elektronegatibitate-diferentzia 1,7 baino txikiagoa izan behar da. Lotura hau elementu berdineko ez-metalen, elementu ezberdineko ez-metalen eta hidrogeno eta ez-metalaren artean ematen da. Bi atomoren artean elektroi bat, bi edo hiru parteka daitezke; ondorioz, lotura bakuna, bikoitza edo hirukoitza osatuko da. Lewis egituran bi atomoen artean marra bat (lotura bakunaren kasuan) marrazten da haien arteko lotura adierazteko[1][2].
Lotura kobalenteen artean elkarrekintza mota asko daude σ lotura, π lotura, metal-metal lotura, elkarrekintza agostikoa, lotura flexionatuak eta hiru zentro eta bi elektroi loturak[3][4][5]. Terminoa 1939an sortu zen[6], eta ko- aurrizkia eta balentzia hitzak elkartzen ditu.
- ↑ Basterretxea, Francisco; Zabala; Gorka; Mijangos, Fernando; Izurieta, Itziar; Etxebarria, Nestor & Martinez de Marigorta, Edorta. (1996). Kimika orokorra. Udako Euskal Unibertsitatea, 64-66 or. ISBN 84-86967-71-6..
- ↑ Arrasate, Sonia & Anakabe, Eneritz. Kimika. , Euskal Herriko Unibertsitatea or. ISBN 978-84-9860-831-1..
- ↑ 1929-1997., March, Jerry,. (1992). Advanced organic chemistry : reactions, mechanisms, and structure. (4th ed. argitaraldia) Wiley ISBN 0471601802. PMC 25204734..
- ↑ 1949-, Miessler, Gary L.,. (2004). Inorganic chemistry. (3rd ed. argitaraldia) Pearson Education ISBN 0130354716. PMC 52165864..
- ↑ Arbeloa Lopez, Teresa. (2010). Kimikaren oinarriak. Euskal Herriko Unibertsitatea, 132-163 or..
- ↑ (Ingelesez) Merriam-Webster. 2018-05-15 (Noiz kontsultatua: 2018-05-31).