| Dichlore | ||

| ||
 | ||
| Dichlore dans une ampoule. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | dichlore | |
| No CAS | ||
| No ECHA | 100.029.053 | |
| No CE | 231-959-5 | |
| No E | E925 | |
| Apparence | gaz jaune-verdâtre, d'odeur âcre[1] | |
| Propriétés chimiques | ||
| Formule | Cl2 [Isomères] |
|
| Masse molaire[2] | 70,906 ± 0,004 g/mol Cl 100 %, |
|
| Propriétés physiques | ||
| T° fusion | −101 °C[1] | |
| T° ébullition | −34,6 °C[1] | |
| Solubilité | 14,6 g l−1 dans l'eau à 0 °C, 7,3 g l−1 à 20 °C, 5,7 g l−1 à 30 °C[réf. souhaitée] |
|
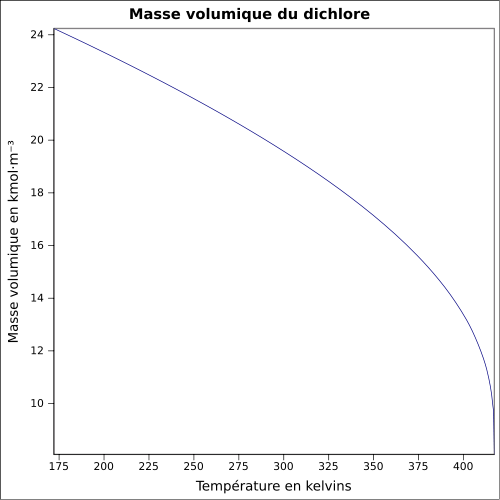
| Masse volumique | 2,48 (densité par rapport à l'air) à 20 °C, 6,864 atm : 1,408 5 g cm−3 (liq.) à −35 °C, 0,994 9 atm : 1,564 9 g cm−3 (liq.) |
|
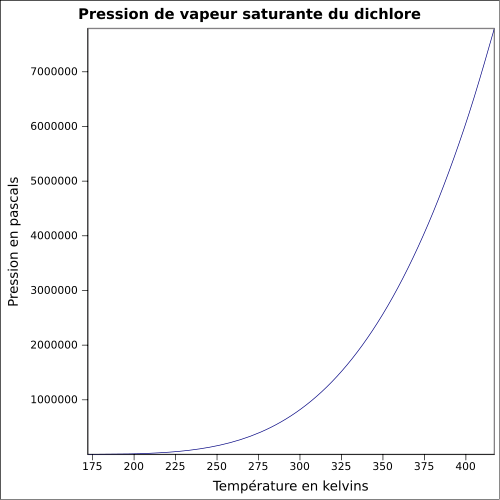
| Pression de vapeur saturante | 6,776 bar à 20 °C 8,8 bar à 30 °C 14,3 bar à 50 °C |
|
| Point critique | 143,81 °C 79,914 bar 0,576 88 kg l−1[réf. souhaitée] |
|
| Point triple | −100,98 °C 0,013 87 bar[réf. souhaitée] |
|
| Vitesse du son | 206 m s−1 (0 °C, 1 atm)[4] | |
| Thermochimie | ||
| ΔvapH° | 20,41 kJ mol−1 (1 atm, −34,04 °C) ; 17,65 kJ mol−1 (1 atm, 25 °C)[5] |
|
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 11,480 ± 0,005 eV (gaz)[6] | |
| Cristallographie | ||
| Symbole de Pearson | [7] | |
| Classe cristalline ou groupe d’espace | Cmca (no 64)[7] | |
| Strukturbericht | A14[7] | |
| Structure type | I2[7] | |
| Précautions | ||
| SGH[8] | ||
| H270, H315, H319, H330, H335 et H400 |
||
| SIMDUT[9] | ||
   A, D1A, E, |
||
| NFPA 704 | ||
| Transport | ||
| Inhalation | odeur suffocante | |
| Écotoxicologie | ||
| CL50 | 1 heure : rat 293 ppm souris 137 ppm |
|
| Seuil de l’odorat | bas : 0,02 ppm haut : 3,4 ppm[10] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le dichlore (Cl2) est un gaz jaune-vert (chloros signifie « vert » en grec) dans les conditions normales de température et de pression. Il est 2,5 fois plus dense que l'air. Il a une odeur suffocante très désagréable et est extrêmement toxique car il se recombine avec l'humidité des muqueuses et des poumons pour former des acides qui attaquent les tissus.
Le dichlore a été découvert par Carl Wilhelm Scheele en 1774. Il a été utilisé lors de la Première Guerre mondiale en tant que gaz de combat, la bertholite.
Le dichlore est soluble dans l'eau, formant l'eau de chlore, mais il n'est pas soluble dans l'eau salée.
La molécule de dichlore est formée de deux atomes de chlore.
- CHLORE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « The Molecular Iodine (I2) Crystal Structure (A14) », sur cst-www.nrl.navy.mil (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- « Chlore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Chlorine », sur hazmap.nlm.nih.gov (consulté le ).