
Back Oddo–Harkins rule English Regla de Oddo-Harkins Spanish Oddo-Harkinsi reegel Estonian Oddo–Harkins-szabály Hungarian Regola di Oddo-Harkins Italian 오도-하킨스 규칙 Korean Правило Оддо-Гаркінса Ukrainian
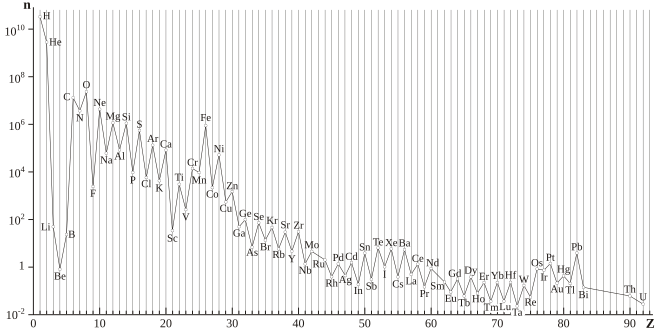
L’effet d'Oddo-Harkins est le résultat observé de la plus grande abondance naturelle des éléments de numéros atomiques supérieurs à 4 lorsque ces numéros sont pairs que lorsqu'ils sont impairs. Cela a été observé pour la première fois par Giuseppe Oddo[1] en 1914 et par William Draper Harkins[2] en 1917[3].
Cet effet s'observe à l'échelle de la Voie lactée aussi bien que du système solaire et, dans une certaine mesure, de la croûte terrestre, où, par exemple, l'abondance relative des lanthanides, qui forment une famille de quinze éléments aux propriétés chimiques très homogènes, est sujette à cet effet :
57 La lanthane 39,0 mg/kg 58 Ce cérium 66,5 mg/kg 59 Pr praséodyme 9,2 mg/kg 60 Nd néodyme 41,5 mg/kg 61 Pm prométhium Traces 62 Sm samarium 7,05 mg/kg 63 Eu europium 2,0 mg/kg 64 Gd gadolinium 6,2 mg/kg 65 Tb terbium 1,2 mg/kg 66 Dy dysprosium 5,2 mg/kg 67 Ho holmium 1,3 mg/kg 68 Er erbium 3,5 mg/kg 69 Tm thulium 0,52 mg/kg 70 Yb ytterbium 3,2 mg/kg 71 Lu lutécium 0,8 mg/kg
D'une manière générale, plus de 80 % des 274 nucléides stables ou quasi stables comptent un nombre pair de protons, et plus de 60 % ont à la fois un nombre pair de protons et un nombre pair de neutrons.
Il s'ensuit que tous les spectres d'abondance naturelle des éléments présentent une structure en dents de scie.
Ceci semble corrélé au fait que l'énergie de liaison nucléaire est plus élevée pour les nombres pairs de chaque type de nucléons (protons et neutrons dans les noyaux à nombre magique) que pour les nombres impairs, comme le montre le tableau de données[4] suivant pour les trois premières périodes :
Z N Élément Énergie de liaison
par proton (MeV)Énergie de liaison
par neutron (MeV)1 1 Hydrogène[a] 2,225 2,225 2 2 Hélium 19,814 20,578 3 3 Lithium 4,588 5,663 4 4 Béryllium 17,255 18,900 5 5 Bore 6,586 8,436 6 6 Carbone 15,957 18,722 7 7 Azote 7,551 10,553 8 8 Oxygène 12,127 15,664 9 9 Fluor 5,607 9,149 10 10 Néon 12,844 16,865 11 11 Sodium 6,740 11,070 12 12 Magnésium 11,693 16,531 13 13 Aluminium 6,306 11,365 14 14 Silicium 11,585 17,180 15 15 Phosphore 5,595 11,319 16 16 Soufre 8,864 15,042 17 17 Chlore 5,143 11,508 18 18 Argon 8,507 15,255
- Giuseppe Oddo, « Die Molekularstruktur der radioaktiven Atome », Zeitschrift für Anorganische Chemie, vol. 87, , p. 253–268 (DOI 10.1002/zaac.19140870118, lire en ligne)
- William D. Harkins, « The Evolution of the Elements and the Stability of Complex Atoms », Journal of the American Chemical Society, vol. 39, no 5, , p. 856–879 (DOI 10.1021/ja02250a002, lire en ligne)
- John North, Cosmos an illustrated history of astronomy and cosmology, Univ. of Chicago Press, , Rev. and updated éd., 602 p. (ISBN 978-0-226-59441-5, lire en ligne)
- (en) San José State University : The Shell Model of Nuclear Structure.
Erreur de référence : Des balises <ref> existent pour un groupe nommé « alpha », mais aucune balise <references group="alpha"/> correspondante n’a été trouvée