
Back ريسين Arabic Рицин (белтък) Bulgarian रिसिन Bihari Ricina Catalan Ricin Czech Risin Welsh Ricin Danish Rizin German Ρικίνη Greek Ricin English
| Ricine | ||
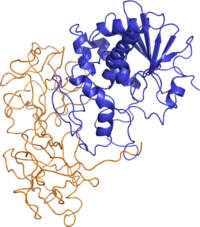 Structure de la ricine. La chaîne A est représentée en bleu et la chaîne B en orange. (PDB 2AAI[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | RCOM_2159910 | |
| Synonymes | R. communis agglutinin II RT ; RTX ; RCA II ; RCA 60 |
|
| Fonction | toxine végétale | |
| Distribution | albumen de la graine | |
| N° EC | 3.2.2.22 | |
| Ricinus communis | ||
| Localisation | génome complet : 0 - 0,01 Mb | |
| Masse moléculaire | ~64 000 Da[2] | |
| Entrez | 8287993 | |
| UniProt | P02879 | |
| RefSeq (ARNm) | XM_002534603.1 | |
| RefSeq (protéine) | XP_002534649.1 | |
| Ricine | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No RTECS | VJ2625000 | ||
| PubChem | 4564 | ||
| Précautions | |||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 30 mg·kg-1 (souris, oral)[4] 5-10 μg·kg-1 (souris, i.v.)[4] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
La ricine /ʁisin/ est une glycoprotéine et une toxine végétale produite par une plante de la famille des Euphorbiaceae, le ricin commun (Ricinus communis). Il s'agit d'un hétérodimère constitué de deux chaînes polypeptidiques, où la chaîne B est une lectine et la chaîne A agit comme une protéine inactivatrice de ribosome[5]. Son mécanisme d'action lui confère une forte cytotoxicité, qui fait de la ricine l'une des substances les plus toxiques connues par l'homme.
La dose létale médiane (DL50) de la ricine chez la souris est d'environ 5 microgrammes par kilogramme de poids corporel par injection intraveineuse. La dose létale orale de la ricine chez l'homme a été estimée entre 1 et 20 µ g/kg de poids corporel (environ 5 à 10 graines de ricin)[6],[4].
La ricine est considérée comme une arme biologique potentielle[7]. Elle est classée comme « agent biologique de catégorie B » par le CDC d'Atlanta[8] et comme « Select Agent » par le HHS[9] et inscrite au tableau 1A (Schedule 1) de la Convention sur l'interdiction des armes chimiques[10]. Plusieurs cas de son utilisation comme poison ont été rapportés, le plus notoire étant l'assassinat du journaliste bulgare Guéorgui Markov[11].
- (en) Earl Rutenber, Betsy J. Katzin, Stephen Ernst, Edward J. Collins, Debra Mlsna, Michael P. Ready et Jon D. Robertus, « Crystallographic refinement of ricin to 2.5 Å », Proteins, vol. 10, no 3, , p. 240-250 (PMID 1881880, DOI 10.1002/prot.340100308, lire en ligne).
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- CDC NIOSH, « Ricin: Biotoxin », sur cdc.gov (consulté le )
- Audi 2005.
- Olsnes et Pihl 1982.
- Bradberry 2003.
- Millard et LeClaire 2008.
- (en) Centers for Disease Control and Prevention, « Bioterrorism Agents/Diseases », sur emergency.cdc.gov (consulté le )
- (en) Federal Select Agent Program, « Select Agents and Toxins List », sur selectagents.gov (consulté le )
- Organisation pour l'interdiction des armes chimiques, « Convention sur l'Interdiction de la Mise au Point, de la Fabrication, du Stockage et de l'Emploi des Armes Chimiques et sur leur Destruction » [PDF], sur opcw.org (consulté le )
- Olsnes 2004.

