
Back قانون جاي-لوساك Arabic Закон Гей-Люсака Byelorussian Закон на Гей-Люсак Bulgarian Gay-Lussacov zakon BS Gay-Lussacův zákon Czech Гей-Люссак саккунĕ CV Gay-Lussacs lov Danish Thermische Zustandsgleichung idealer Gase#Gesetz von Gay-Lussac German Νόμος Γκαι-Λυσάκ Greek Gay-Lussac's law English

Gay-Lussacov zakon ili prvi Gay-Lussacov zakon (ponekad i Charles-Gay-Lussacov zakon) utvrđuje ovisnost tlaka ili obujma (volumena) idealnog plina o temperaturi. Ako plin na temperaturi 0 °C ima tlak P0 i volumen V0, tada je, uz isti volumen, kod temperature T (u °C), tlak:
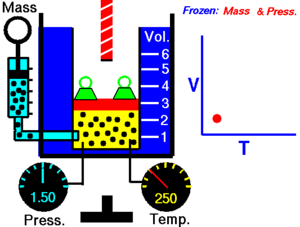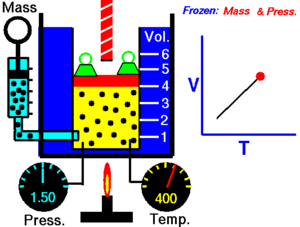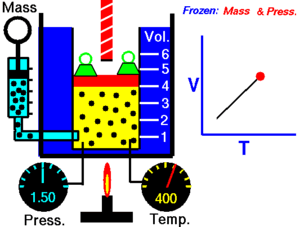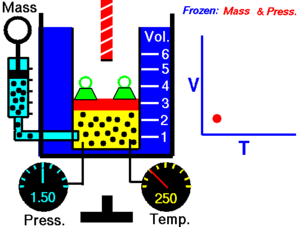
Promjena stanja plina koja se zbiva uz stalan obujam naziva se izohorna promjena stanja. Mjerenjima je ustanovljeno da se tlak plina kod stalnog obujma povišenjem temperature za 1 °C povisi uvijek za 1/273,15 dio onog tlaka koji je plin imao kod 0 °C. Taj se broj označuje s β i zove se termički ili toplinski koeficijent tlaka plina. Taj termički ili toplinski koeficijent tlaka plina jednak je kubnom koeficijentu rastezanja plina. Tlakovi neke količine plina kod stalnog obujma odnose se kao njihove apsolutne temperature.[1]
Ako je tlak stalan, onda je obujam ili volumen:
Prema tome, rastezanje plina kod stalnog tlaka upravno je razmjerno povišenju temperature. Promjena stanja plina koja se zbiva uz stalan tlak naziva se izobarna promjena stanja. Gay-Lussac je ustanovio mjerenjem i pokusima da se povećanje obujma plinova kod stalnog tlaka zbiva po istom zakonu koji važi za kruta i tekuća tijela samo s kubnim koeficijentom rastezanja β = 0,003 66 = 1 / 273,15.
Gay-Lussacov zakon je otkrio Joseph Louis Gay-Lussac 1809. On je tvrdio da je tlak P u nekom spremniku, koji ima konstantan obujam, direktno sukladan (proporcionalan) s apsolutnom temperaturom T (u kelvinima). Povećanjem temperature, molekule plina postaju sve brže i snažnije udaraju na stijenke spremnika. Matematički se taj zakon može opisati kao:
gdje je: T - apsolutna temperatura (K), P – tlak plina (Pa) i k3 – konstanta.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.


