
Back طاقة غيبس الحرة Arabic Enerxía de Gibbs AST Gibbs enerjisi Azerbaijani Свободна енергия на Гибс Bulgarian গিবস মুক্ত শক্তি Bengali/Bangla Gibbsova slobodna energija BS Energia de Gibbs Catalan وزەی ڕەھای گیبس CKB Gibbsova volná energie Czech Gibbs fri energi Danish

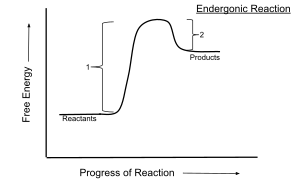

Gibbsova slobodna energija, Gibbsova energija, Gibbsov potencijal ili slobodna entalpija (oznaka G) je fizikalna veličina koja opisuje oslobođenu ili apsorbiranu energiju u nekom povratnom (reverzibilnom) procesu koji se odvija pri stalnoj temperaturi T i tlaku p. Definirana je kao entalpija H umanjena za umnožak entropije S i temperature T:
ili
gdje je: V - volumen, a U - unutarnja energija termodinamičkog sustava. Pri minimalnoj promjeni Gibbsove energije (ΔG = 0), uz stalnu temperaturu i tlak, sustav je u kemijskoj ravnoteži. U spontanim se procesima Gibbsova energija smanjuje (ΔG < 0), a entropija se povećava. Promjena je Gibbsove energije pozitivna (ΔG > 0) samo onda kada se u sustav dovodi energija. Mjerna jedinica Gibbsove energije jest džul (J). Nazvana je po J. W. Gibbsu.[1]

