
Back نظائر اليود Arabic Isòtops del iode Catalan Izotopy jodu Czech Йод изотопĕсем CV Isotopes of iodine English Izotopoj de jodo Esperanto Anexo:Isótopos de yodo Spanish ایزوتوپهای ید Persian Isotopes de l'iode French A jód izotópjai Hungarian
Artikel ini membutuhkan rujukan tambahan agar kualitasnya dapat dipastikan. (Juli 2022) |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar Ar°(I) |
| |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Ada 37 isotop iodin (53I) yang diketahui, mulai dari 108I hingga 144I; semuanya mengalami peluruhan radioaktif kecuali 127I, yang stabil. Dengan demikian, iodin merupakan unsur monoisotop.
Isotop radioaktifnya yang berumur paling panjang, 129I, memiliki waktu paruh 15,7 juta tahun, yang terlalu pendek untuk eksis sebagai nuklida primordial. Sumber kosmogenik 129I menghasilkan jumlah yang sangat kecil yang terlalu kecil untuk mempengaruhi pengukuran berat atom; dengan demikian iodin juga merupakan unsur mononuklida—unsur yang hanya memiliki satu nuklida yang dapat ditemukan di alam. Sebagian besar radioaktivitas turunan 129I di Bumi adalah buatan manusia, produk sampingan berumur panjang yang tidak diinginkan dari uji coba nuklir awal dan kecelakaan fisi nuklir.
Semua radioisotop iodin lainnya memiliki waktu paruh kurang dari 60 hari, dan empat di antaranya digunakan sebagai pelacak dan agen terapeutik dalam pengobatan. Mereka adalah 123I, 124I, 125I, dan 131I. Semua produksi industri isotop iodin yang radioaktif melibatkan keempat radionuklida yang berguna ini.
Isotop 135I memiliki waktu paruh kurang dari tujuh jam, yang terlalu pendek untuk digunakan dalam biologi. Produksi in situ yang tidak dapat dihindari dari isotop ini penting dalam pengendalian reaktor nuklir, karena ia meluruh menjadi 135Xe, penyerap neutron paling kuat yang diketahui, dan nuklida yang bertanggung jawab atas apa yang disebut fenomena biji iodin.
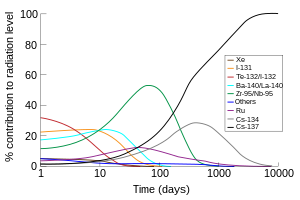
Selain produksi komersial, 131I (waktu paruh 8 hari) merupakan salah satu produk fisi radioaktif umum dari fisi nuklir, dan diproduksi secara tidak sengaja dalam jumlah yang sangat besar di dalam reaktor nuklir. Karena volatilitasnya, waktu paruhnya yang pendek, dan kelimpahannya yang tinggi dalam produk fisi, 131I (bersama dengan isotop iodin berumur pendek 132I, yang dihasilkan dari peluruhan 132Te dengan waktu paruh 3 hari) bertanggung jawab atas bagian terbesar dari kontaminasi radioaktif selama minggu pertama setelah kontaminasi lingkungan yang tidak disengaja dari limbah radioaktif dari pembangkit listrik tenaga nuklir. Jadi, suplemen iodin dosis tinggi (biasanya kalium iodida) diberikan kepada masyarakat setelah kecelakaan nuklir atau ledakan (dan dalam beberapa kasus sebelum kejadian seperti mekanisme pertahanan sipil) untuk mengurangi penyerapan senyawa iodin radioaktif oleh tiroid sebelum isotop radioaktif memiliki waktu untuk meluruh.
- ^ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure Appl. Chem. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ^ "Nuclear Data Evaluation Lab". Diarsipkan dari versi asli tanggal 21 Januari 2007. Diakses tanggal 8 Juli 2022.