
Back Siklopropaan Afrikaans حلقي البروبان Arabic Siklopropan Azerbaijani سیکلوپروپان AZB Цыклапрапан Byelorussian Циклопропан Bulgarian Ciclopropà Catalan Cyklopropan Czech Cyklopropan Danish Cyclopropan German
| Ciclopropano | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
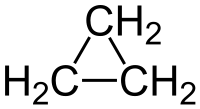
| Formula bruta o molecolare | C3H6 |
| Massa molecolare (u) | 42,08 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-847-8 |
| PubChem | 6351 |
| DrugBank | DBDB13984 |
| SMILES | C1CC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,68 (liq. a -33 °C) |
| Indice di rifrazione | 1,3799 (-42 °C) |
| Solubilità in acqua | 502 mg/L |
| Coefficiente di ripartizione 1-ottanolo/acqua | 1,72 |
| Temperatura di fusione | −127 °C (146 K) |
| Temperatura di ebollizione | −32,8 °C (240,4 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 410+403 [1][2] |
Il ciclopropano è un idrocarburo ciclico formato da tre atomi di carbonio e da sei atomi di idrogeno (C3H6) o (CH2)3, da cui il vecchio nome di trimetilene datogli dallo scopritore A. Freund nel 1882.[3] È una molecola di simmetria elevata (D3h)[4] ed il più semplice dei cicloalcani. L'anello è il più piccolo possibile: questo e la tensione che ne deriva (vide infra) fa del ciclopropano una molecola di notevole interesse teorico[5][6] e determina inoltre una particolare reattività, con la possibilità di apertura dell'anello stesso e quindi della rottura di un legame C–C.[7]
A temperatura ambiente è un gas incolore facilmente liquefacibile, dall'odore idrocarburico dolce, molto infiammabile.[8] Alcuni suoi derivati rivestono importanza in campo biologico e biochimico.[9] È stato usato come anestetico.[10]
- ^ scheda del ciclopropano su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Sigma Aldrich; rev. del 13.01.2012
- ^ (DE) August Freund, Über Trimethylen, in Monatshefte für Chemie, vol. 3, n. 1, 1882-12, pp. 625–635, DOI:10.1007/BF01516828. URL consultato l'8 dicembre 2020.
- ^ Character table for point group D3h, su symmetry.jacobs-university.de. URL consultato il 14 gennaio 2022.
- ^ Arthur Greenberg e Joel F. Liebman, Strained organic molecules, collana Organic chemistry, Academic Press, 1978, ISBN 978-0-12-299550-7.
- ^ (EN) Armin de Meijere, Introduction: Cyclopropanes and Related Rings, in Chemical Reviews, vol. 103, n. 4, 1º aprile 2003, pp. 931–932, DOI:10.1021/cr0100289. URL consultato il 7 giugno 2023.
- ^ R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, volume primo, L. G. Guadagni, 1974, p. 154.
- ^ (EN) PubChem, Cyclopropane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 14 gennaio 2022.
- ^ Rüdiger Faust, Fascinating Natural and Artificial Cyclopropane Architectures, in Angewandte Chemie International Edition, vol. 40, n. 12, 18 giugno 2001, pp. 2251–2253, DOI:10.1002/1521-3773(20010618)40:12<2251::AID-ANIE2251>3.0.CO;2-R. URL consultato il 5 giugno 2023.
- ^ (EN) Edmond I. Eger, Bernard Brandstater e Lawrence J. Saidman, Equipotent Alveolar Concentrations of Methoxyflurane, Halothane, Diethyl Ether, Fluroxene, Cyclopropane, Xenon and Nitrous Oxide in the Dog, in Anesthesiology, vol. 26, n. 6, 1º novembre 1965, pp. 771–777, DOI:10.1097/00000542-196511000-00012. URL consultato l'8 dicembre 2020.