
Back Chloroform Afrikaans كلوروفورم Arabic Xloroform Azerbaijani کولوروفرم AZB Хлараформ Byelorussian Хляраформ BE-X-OLD Хлороформ Bulgarian ကလိုရိုဖောင်း BLK ক্লোরোফরম Bengali/Bangla Hloroform BS
| Cloroformio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triclorometano | |
| Nomi alternativi | |
| freon 20 CFC 20 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CHCl3 |
| Massa molecolare (u) | 119,38 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-663-8 |
| PubChem | 6212 |
| DrugBank | DBDB11387 |
| SMILES | C(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,47 |
| Solubilità in acqua | 8 g/l a 293 K |
| Temperatura di fusione | −63 °C (210 K) |
| Temperatura di ebollizione | 61 °C (334 K) |
| ΔebH0 (kJ·mol−1) | 31,4 |
| Tensione di vapore (Pa) a 293 K | 21300 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −134,1 |
| ΔfG0 (kJ·mol−1) | −73,7 |
| S0m(J·K−1mol−1) | 201,7 |
| C0p,m(J·K−1mol−1) | 114,2 |
| Indicazioni di sicurezza | |
| Temperatura di autoignizione | 982 °C (1255 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 315 - 319 - 331 - 336 - 351 - 361d - 372 |
| Consigli P | 201 - 202 - 260 - 264 - 270 - 271 - 280 - 281 - 301+330+331 - 302+352 - 304+340 - 305+351+338 - 308+313 - 314 |
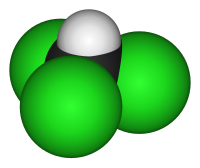
Il cloroformio, nome IUPAC triclorometano, è un composto chimico di formula CHCl3. È un alometano e in particolare un aloformio (trialogenometano),[1] che è il nome alla serie costituita, oltre ad esso, da CHF3 (fluoroformio), CHBr3 (bromoformio) e CHI3 (iodoformio), in cui l'atomo di carbonio è allo stato di ossidazione +2. È noto anche con le sigle commerciali freon 20 o CFC 20.
La sua struttura chimica deriva formalmente da quella di una molecola di metano in cui tre atomi di idrogeno sono stati sostituiti da tre atomi di cloro, con l'atomo di carbonio collocato al centro, ibridato sp3. Ne risulta una forma tetraedrica distorta avente simmetria C3v.[2]
A temperatura ambiente è un liquido incolore, denso (d = 1,47 g/mL), abbastanza volatile (Teb = 61 °C), dal caratteristico odore dolciastro. Non è infiammabile da solo, ma lo è in miscela con altri composti infiammabili.
È un composto nocivo alla salute umana e all'ambiente, nonché un forte sospetto cancerogeno.
Il cloroformio, esposto alla luce e in presenza di ossigeno atmosferico si trasforma nel ben più tossico e pericoloso fosgene. Per questo motivo viene conservato in contenitori ambrati e ben chiusi.
- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, pp. 117-118.
- ^ CCCBDB Experimental Data page 1, su cccbdb.nist.gov. URL consultato il 19 febbraio 2023.