
Back Hemoglobien Afrikaans هيموغلوبين Arabic هيموجلوبين ARZ হিম’গ্ল’বিন Assamese Hemoglobina AST Hemoqlobin Azerbaijani هموقلوبین AZB Гемоглобин Bashkir Hemoglobin BCL Гемаглабін Byelorussian
| |
Šiam straipsniui ar jo daliai trūksta išnašų į patikimus šaltinius. Jūs galite padėti Vikipedijai pridėdami tinkamas išnašas su šaltiniais. |
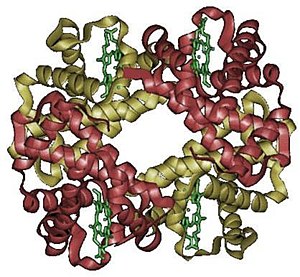
Hemoglobinas (Hb) – tai chromoproteinas (gr. chroma – dažas), t. y. baltymas, turintis spalvotą prostetinę grupę – hemą (geležies turintį porfiriną). Jo baltyminė dalis (globinas) yra sudaryta iš keturių nekovalentiškai susijungusių polipeptidinių grandinių, kurių kiekvienoje yra po hemą. Hemoglobinui jungiantis su dujomis (O2, CO2, CO) pagrindinį vaidmenį atlieka geležis.

Hemo pagrindą sudaro protoporfirinas IX, kurio centre yra su azotu sąveikaujantis (du koordinaciniai ir du kovalentiniai ryšiai) geležies atomas. Geležis gali būti oksiduotoje Fe3+ arba redukuotoje Fe2+ formose. Oksiduotą geležies atomą turintis Hb vadinamas ferihemoglobinu, o redukuotą – ferohemoglobinu. Geležies atomas, be aukščiau minėtos sąveikos su keturiais pirolo azoto atomais, sąveikauja iš vienos porfirino žiedo pusės su baltymo histidinu, o iš kitos pusės su prisijungiančiu deguonimi. Svarbu ir tai, kad iš tos hemo žiedo pusės, kur jungiasi deguonis, yra dar vienas histidinas, kuris steriškai trukdo prisijungti anglies monoksidui vietoj deguonies. Paminėtina, kad hemoglobino vidinė dalis yra nepolinė ir joje nėra H2O, kurie trukdytų geležies oksidacijai.
Hemoglobinas, gausiausias eritrocitų baltymas, stuburinių organizmuose neša deguonį iš plaučių į kūno audinius ir parneša dalį CO2 iš audinių į plaučius.