
Back Swaelsuur Afrikaans حمض الكبريتيك Arabic حمض كبريتي ARY Ácidu sulfúrico AST Sulfat turşusu Azerbaijani سولفوریک اسید AZB Серная кіслата Byelorussian Серчаная кісьля BE-X-OLD Сярна киселина Bulgarian সালফিউরিক অ্যাসিড Bengali/Bangla
| Zwavelzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
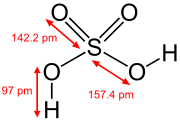
Structuurformule van zwavelzuur
| ||||

| ||||
Molecuulmodel van zwavelzuur
| ||||

| ||||
Fles met zwavelzuur (96%)
| ||||
| Algemeen | ||||
| Molecuulformule | H2SO4 | |||
| IUPAC-naam | diwaterstofsulfaat | |||
| Andere namen | zwavel(VI)zuur, vitrioololie, vitriool | |||
| Molmassa | 98,07848 g/mol | |||
| SMILES | OS(=O)(=O)O
| |||
| InChI | 1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4)
| |||
| CAS-nummer | 7664-93-9 | |||
| EG-nummer | 231-639-5 | |||
| PubChem | 1118 | |||
| Wikidata | Q4118 | |||
| Beschrijving | Sterk zuur en zeer corrosieve, hygroscopische vloeistof | |||
| Vergelijkbaar met | zwaveligzuur, salpeterzuur, fosforzuur, chroomzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 - P264 - P280 - P363 | |||
| Hygroscopisch? | ja | |||
| Omgang | Uiterst voorzichtig behandelen, gebruik makend van zuurbestendige handschoenen en een gezichtsmasker. | |||
| Opslag | In een afgesloten glazen fles, droog en in een goed geventileerde ruimte bewaren. Gescheiden van basen, metalen en organische stoffen. | |||
| EG-Index-nummer | 016-020-00-8 | |||
| VN-nummer | 1830 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| MAC-waarde | 0,1 mg/m³ | |||
| LD50 (ratten) | (oraal) 2140[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,8356 g/cm³ | |||
| Smeltpunt | 10,38 °C | |||
| Kookpunt | 330 °C | |||
| Dampdruk | (bij 145,8°C) 1300 Pa | |||
| Goed oplosbaar in | water | |||
| Viscositeit | (bij 20°C) 0,0267 Pa·s | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−810,4097[2] kJ/mol | |||
| S |
157,2504[3] J/mol·K | |||
| Evenwichtsconstante(n) | pKa1 = −3,0[4] pKa2 = 1,99[4] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Zwavelzuur – vroeger ook wel vitriool genoemd – is een industrieel belangrijk anorganisch zuur met als brutoformule H2SO4. Onder standaardomstandigheden komt het voor als een kleurloze, geurloze, viskeuze en sterk hygroscopische vloeistof met een glasachtige glans, die volledig mengbaar is met water. Zwavelzuur wordt vrijwel altijd in de vorm van een waterige oplossing verhandeld en gebruikt.
Zwavelzuur is een van de belangrijkste universeel toegepaste grondstoffen in de chemische industrie. In 2001 werd wereldwijd bijna 165 miljoen ton geproduceerd.[5] Het voornaamste proces voor de productie van zwavelzuur is het contactproces, waarbij globaal gezien zwaveldioxide (SO2) met zuurstofgas (O2) geoxideerd wordt tot zwaveltrioxide (SO3), dat vervolgens gehydrateerd wordt. Vroeger werd het lodenkamerproces toegepast, maar daarmee kon geen sterk geconcentreerd zwavelzuur geproduceerd worden.
Een van de grootste afnemers van zwavelzuur is de kunstmeststoffenindustrie. Daarnaast wordt het toegepast als elektrolyt in loodaccu's, als (industrieel) schoonmaakmiddel, bij de synthese van sulfaatzouten, bij de raffinage van aardolie, als droogmiddel voor gassen en als reagens bij organische syntheses.
De zouten en esters van zwavelzuur worden sulfaten genoemd. In oude teksten worden de zouten ook als vitriolen aangeduid: zo verwijst kopervitriool naar koper(II)sulfaat. Tal van sulfaatzouten komen in de natuur voor in de vorm van mineralen. Enkele voorbeelden daarvan zijn calciumsulfaat (CaSO4) als gips en anhydriet, bariumsulfaat (BaSO4) als bariet, strontiumsulfaat (SrSO4) als celestien en ijzer(II)sulfaat (FeSO4) als melanteriet (dat ook ijzervitriool wordt genoemd).
De eigenschappen van zwavelzuur zijn sterk afhankelijk van de concentratie van de oplossing. In zuivere toestand is het sterk corrosief tegenover metalen, cellulair weefsel en gesteenten; een gedrag dat kan worden toegeschreven aan het sterk zure karakter van de stof, alsmede aan de dehydraterende en oxiderende aard van zwavelzuur. Om opspatten bij het maken van verdunningen te voorkomen, dient het zuur aan water te worden toegevoegd en niet omgekeerd.[6] Bij contact met de huid kunnen ernstige brandwonden ontstaan. Verder werkt zwavelzuur destructief op het hoornvlies en kan het blindheid veroorzaken.
- ↑ (en) MSDS van zwavelzuur, ScienceLab
- ↑ Zeleznik (1991), p. 1183
- ↑ Zeleznik (1991), p. 1186
- ↑ a b (en) pKa Data Compiled by R. Williams
- ↑ Sulfuric Acid, in Chemical Economics Handbook, SRI International, Menlo Park, Californië, januari 2003
- ↑ Onder scheikundigen bestaan hieromtrent enkele ezelsbruggetjes, waaronder water op zuur is bloed aan de muur of een sterk zuur laat zich niet dopen.
