
Back Koolstofdioksied Afrikaans Kohlenstoffdioxid ALS ካርቦን ክልቶኦክሳይድ Amharic Dioxido de carbonio AN ثنائي أكسيد الكربون Arabic কাৰ্বন ডাই অক্সাইড Assamese Dióxidu de carbonu AST Karbon qazı Azerbaijani کربون دیاوکسید AZB Karbon dioksido BCL
| Dioxid de carbon | |
 | |
 | |
 | |
| Nume IUPAC | Dioxid de carbon |
|---|---|
| Alte denumiri | Anhidridă carbonică |
| Identificare | |
| Număr CAS | 124-38-9 |
| ChEMBL | CHEMBL1231871 |
| PubChem CID | 280 |
| Informații generale | |
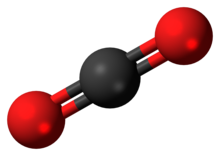
| Formulă chimică | CO2 |
| Aspect | gaz incolor, inodor |
| Masă molară | 44,0099 g/mol |
| Proprietăți | |
| Densitate | 1,9767 kg/m3 (0 °C, 1013 mbar) |
| Starea de agregare | gaz |
| Punct de topire | –56,6 °C (5,3 bar) |
| Punct de fierbere | –78,5 °C (Sublimare) |
| Solubilitate | 3,3 g/l la 0 °C, 1,7 g/l la 20 °C, la 1013 hPa |
| Presiune de vapori | 57,258 bar(20 °C) |
| Fraze S | S9, S23 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |

Dioxidul de carbon, format dintr-un atom de carbon și doi atomi de oxigen, este o anhidridă labilă a acidului carbonic (CO2.H2O ~ H2CO3), un compus chimic rezultat din oxidarea carbonului, în majoritate de origine organică. Pe de altă parte, este un produs secundar în procese industriale, cum ar fi producția de ciment, oțel, amoniac, metanol, etilena, acid acetic, acid acrilic și alți compuși organici. Pentru a reduce emisiile nete, este esențial creșterea eficienței proceselor chimice[2][3] și, pe de altă parte, captarea și transformarea a CO2 în combustibili[4][5] și compuși organici[6][7][8][9].
Prezent în atmosferă în concentrația de circa 0,04 %, este strict necesar pentru păstrarea echilibrului biosferei.
- ^ „Dioxid de carbon”, carbon dioxide (în engleză), PubChem, accesat în
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF). .
- ^ „The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts”. Journal of Catalysis. 311: 369–385. .
- ^ de Araujo, Gabriel E.; de Castro, Jéssica H.; Monteiro, Wesley F.; de Lima, Jeane; Ligabue, Rosane A.; Lourega, Rogerio V. (), „Methanation of CO2 from flue gas: experimental study on the impact of pollutants”, Reaction Kinetics, Mechanisms and Catalysis (în engleză), 134 (2), pp. 743–757, doi:10.1007/s11144-021-02092-8, ISSN 1878-5204, accesat în
- ^ Chatzilias, Christos; Martino, Eftychia; Katsaounis, Alexandros; Vayenas, Constantinos G. (), „Electrochemical promotion of CO2 hydrogenation in a monolithic electrochemically promoted reactor (MEPR)”, Applied Catalysis B: Environmental (în engleză), 284, p. 119695, doi:10.1016/j.apcatb.2020.119695, ISSN 0926-3373, accesat în
- ^ Regenerative Synthese von chemischen Energiespeichern und Feinchemikalien, accesat în
- ^ „CO2 from the air as a raw material for chemicals” (în engleză). www.biooekonomie-bw.de. Accesat în .
- ^ Torquato, Lilian D. Moura; Pastrian, Fabián A. C.; Perini, João A. Lima; Irikura, Kallyni; de L. Batista, Ana Paula; de Oliveira-Filho, Antonio G. S.; Córdoba de Torresi, Susana I.; Zanoni, Maria V. Boldrin (), „Relation between the nature of the surface facets and the reactivity of Cu2O nanostructures anchored on TiO2NT@PDA electrodes in the photoelectrocatalytic conversion of CO2 to methanol”, Applied Catalysis B: Environmental (în engleză), 261, p. 118221, doi:10.1016/j.apcatb.2019.118221, ISSN 0926-3373, accesat în
- ^ Bonura, G.; Todaro, S.; Frusteri, L.; Majchrzak-Kucęba, I.; Wawrzyńczak, D.; Pászti, Z.; Tálas, E.; Tompos, A.; Ferenc, L. (), „Inside the reaction mechanism of direct CO2 conversion to DME over zeolite-based hybrid catalysts”, Applied Catalysis B: Environmental (în engleză), 294, p. 120255, doi:10.1016/j.apcatb.2021.120255, ISSN 0926-3373, accesat în