
Back Kaliumkarbonaat Afrikaans كربونات البوتاسيوم Arabic بوتاس ARZ پوتاسیوم کربونات AZB Калиев карбонат Bulgarian পটাশিয়াম কার্বনেট Bengali/Bangla Carbonat de potassi Catalan Uhličitan draselný Czech Сĕлтĕ мымми CV Potaske Danish
| Kalijum karbonat | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC ime |
| ||
| Drugi nazivi | Potaša | ||
| Identifikacija | |||
| CAS registarski broj | 584-08-7 | ||
| MeSH | |||
| RTECS registarski broj toksičnosti | TS7750000 | ||
| |||
| Svojstva | |||
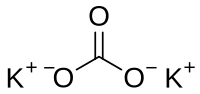
| Molekulska formula | K2CO3 | ||
| Molarna masa | 138.2055 g/mol | ||
| Agregatno stanje | Čvrsta bela higroskopna supstanca | ||
| Gustina | 2.29 g/cm3, osnovno | ||
| Tačka topljenja |
891 °C | ||
| Tačka ključanja |
razgrađuje se | ||
| Rastvorljivost u vodi | 112 g/100 mL (20 °C) | ||
| Opasnost | |||
| NFPA 704 | |||
| Tačka paljenja | nije zapaljiv | ||
| Srodna jedinjenja | |||
| Drugi katjoni | litijum-karbonat, natrijum-karbonat, cezijum-karbonat | ||
|
| |||
| Infobox references | |||
Kalijum karbonat (molekulska formula K2CO3) je hemijsko jedinjenje, kalijumova so ugljene kiseline.[1][2] Kalijum karbonat je bezbojna kristalna supstancija veoma dobro rastvorljiva u vodi; 93.7 g u 100 g vode. Temperatura topljenja kalijum karbonata iznosi 891 °C. On gradi hidrate, u vodenim rastvorima se hidrolizuje. Pod uticajem kiselina podleže raspadu na ugljen dioksid i kalijum oksid.
Kalijum karbonat se dobija uvođenjem ugljen dioksida u vodeni rastvor kalijum hidroksida. Koristi se u industriji stakla, keramike, za produkciju sredstava za pranje, u fotografiji i za dobijanje drugih jedinjenja kalijuma.
Molekulska masa kalijum karbonata je 138.2 u.
- ↑ Housecroft C. E., Sharpe A. G. (2008). Inorganic Chemistry (3rd izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ↑ Holleman A. F., Wiberg E. (2001). Inorganic Chemistry (1st edition izd.). San Diego: Academic Press. ISBN 0-12-352651-5.
