
Back فوق أكسيد البوتاسيوم Arabic پتاسیوم سوپر اوکسید AZB Калиев супероксид Bulgarian Superoxid draselný Czech Kaliumhyperoxid German Potassium superoxide English Kalia superoksido Esperanto Superóxido de potasio Spanish پتاسیوم سوپر اکسید Persian Kaliumsuperoksidi Finnish
| Kalijum superoksid | |||
|---|---|---|---|
| |||
| IUPAC ime |
| ||
| Drugi nazivi | Kalijum superoksid | ||
| Identifikacija | |||
| CAS registarski broj | 12030-88-5 | ||
| PubChem[1][2] | 61541 | ||
| RTECS registarski broj toksičnosti | TT6053000 | ||
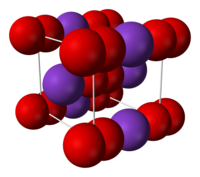
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | KO2 | ||
| Molarna masa | 71.1 g mol−1 | ||
| Agregatno stanje | žita čvrsta materija | ||
| Gustina | 2,14 g/cm3, čvrst | ||
| Tačka topljenja |
560 °C, 833 K, 1040 °F (razlaže se) | ||
| Rastvorljivost u vodi | razlaže se | ||
| Struktura | |||
| Kristalna rešetka/struktura | centralna kubna (O2-) | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
−283 kJ·mol−1[3] | ||
| Standardna molarna entropija S |
117 J·mol−1·K−1[3] | ||
| Opasnost | |||
| Opasnost u toku rada | korozivan, oksidans | ||
| NFPA 704 | |||
| R-oznake | 8-14-34 | ||
| S-oznake | 17-27-36/37/39 | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Kalijum oksid Kalijum peroksid | ||
| Drugi katjoni | Natrijum superoksid | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Kalijum superoksid je hemijsko jedinjenje sa formulom KO2. Ova retka so superoksidnog jona se formira sagorevanjem rastopljenog kalijuma u čistom kiseoniku. Kalijum superoksid se koristi kao oksidacioni agens u industrijskoj hemiji, kao sredstvom za uklanjanje CO2 i H2O iz vazduha, i kao O2 generator u bocama za ronjenje, svemirskim letilicama i podmornicama
Važne reakcije:
- 4 KO2 + 2 H2O → 4 KOH + 3 O2
- 2 KOH + CO2 → K2CO3 + H2O
- K2CO3 + CO2 + H2O → 2 KHCO3
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ 3,0 3,1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. str. A22. ISBN 0-618-94690-X.
