
Back ميوغلوبين Arabic Mioqlobin Azerbaijani Миоглобин Bulgarian মায়োগ্লোবিন Bengali/Bangla Mioglobin BS Mioglobina Catalan Myoglobin Czech Myoglobin Danish Myoglobin German Μυοσφαιρίνη Greek
| edit |
| Mioglobin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
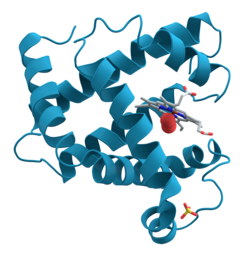 Model heliksnih domena mioglobina.[1] | |||||||||
| Dostupne strukture | |||||||||
| 1m6c, 1m6m, 1mdn, 1mnh, 1mni, 1mnj, 1mnk, 1mno, 1mwc, 1mwd, 1myg, 1myh, 1myi, 1myj, 1pmb, 1yca, 1ycb, 2mm1 | |||||||||
| Identifikatori | |||||||||
| Simboli | MB; MGC13548; PVALB | ||||||||
| Vanjski ID | OMIM: 160000 MGI: 96922 HomoloGene: 3916 GeneCards: MB Gene | ||||||||
| |||||||||
| Pregled RNK izražavanja | |||||||||
 | |||||||||
| podaci | |||||||||
| Ortolozi | |||||||||
| Vrsta | Čovek | Miš | |||||||
| Entrez | 4151 | 17189 | |||||||
| Ensembl | ENSG00000198125 | ENSMUSG00000018893 | |||||||
| UniProt | P02144 | Q3UVB1 | |||||||
| Ref. Sekv. (iRNK) | NM_005368 | NM_013593 | |||||||
| Ref. Sekv. (protein) | NP_005359 | NP_038621 | |||||||
| Lokacija (UCSC) | Chr 22: 34.33 - 34.35 Mb | Chr 15: 76.84 - 76.88 Mb | |||||||
| PubMed pretraga | [1] | [2] | |||||||
Mioglobin je citoplazmatični globularni hemoprotein koji se sastoji od jednog polipeptidnog lanca koji sadrži 154 aminokiselina. To je relativno mali protein, Mr=17.600. Prisutan je u mišićnim ćelijama srca i oksidativnim vlaknima skeletnih mišića. Ime je dobio po mestu nalaženja (grč. myo- što označava povezanost sa mišićima) i obliku (globularni protein). Karakteriše ga funkcionalna sličnost sa hemoglobinom. Kao i hemoglobin, i mioglobin vezuje kiseonik (O2) u oba smera i na taj način olakšava transport O2 od crvenih krvnih zrnaca do mitohondrija mišića za vreme pojačane metaboličke aktivnosti, ili može poslužiti kao rezervoar O2 za vreme hipoksije ili anoksije. Za razliku od hemoglobina, monomer mioglobina sa jednim O2 vezujućim mestom, ima hiperboličnu O2-saturacionu krivu karakterističnu za normalnu Mihaelis-Menten enzimsku kinetiku, pravilniju nego sigmoidnu krivu koja je viđena kod tetrameričnog hemoglobina [2].
Polipeptidni lanac mioglobina je savijen u obliku kolevke, tako da ljulja prostetičnu grupu hem. Vezivanje kiseonika zavisi od oksidacionog stanja gvožđa u hemu. Ono je +2 u hemu i to je oblik koji vezuje kiseonik. Ako Fe pređe iz +2 u +3 oksidaciono stanje nastaće metamioglobin koji ne vezuje kiseonik. Slobodan hem u rastvoru će odmah reagovati sa kiseonikom, ali će kiseonik brzo oksidovati atom gvožđa u Fe3+. Mioglobin obavlja tri kritične funkcije: vezuje hem, štiti gvožđe u hemu od oksidacije i obezbeđuje cep u koji kiseonik može da stane.[3]
- ↑ PDB 1MBO; Takano T (March 1977). „Structure of myoglobin refined at 2.0 Å resolution. II. Structure of deoxymyoglobin from sperm whale”. J. Mol. Biol. 110 (3): 569–84. DOI:10.1016/S0022-2836(77)80112-5. PMID 845960.
- ↑ George A. Ordway and Daniel J. Garry (2004). „Myoglobin: an essential hemoprotein in striated muscle”. Journal of Experimental Biology.
- ↑ Garret R. H., Grisham C. M. (1999). Biochemistry.