Back Аӡы Abkhazian Water Afrikaans Wasser ALS ውሃ Amharic Augua AN Wæter ANG ماء Arabic ܡܝܐ ARC ما ARY ميه ARZ
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
vodikov(I) oksid
| |||
| Druga imena
oksidan, divodikov oksid, voda
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| 3587155 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.902 | ||
| Gmelin | 117 | ||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| H 2O | |||
| Molska masa | 18,01528(33) g/mol | ||
| Videz | brezbarvna tekočina, brez vonja in okusa; brezbarvni plin, trdina, podobna kristalom | ||
| Vonj | brez | ||
| Gostota | Kapljevina:[1] 0,9998396 g/mL pri 0 °C 0,9970474 g/mL pri 25 °C 0,961893 g/mLpri 95 °C Trdnina:[2] 0,9167 g/ml pri 0 °C | ||
| Tališče | 0,00 °C (32,00 °F; 273,15 K) [a] | ||
| Vrelišče | 99,98 °C (211,96 °F; 373,13 K) [3][a] | ||
| N/A | |||
| Topnost | slabo topno v haloalkanih, alifatskih in aromatskih ogljikovodikih ter etrih.[4] Boljša topljivost v karboksilatih, alkoholih, ketonih, aminih. Meša se z metanolom, etanolom, propanolom, izopropanolom, acetonom, glicerolom, 1,4-dioksanom, tetrahidrofuranom, sulfolanom, acetaldehidom, dimetilformamidom, dimetoksietanom, dimetil sulfoksidom, acetonitrilom. Delno se meša z dietil etrom, metil etil ketonom, diklorometanom, etil acetatom in brominom. | ||
| Parni tlak | 3,1690 kilopascal ali 0,031276 atm[5] | ||
| Kislost (pKa) | 13,995[6][7][b] | ||
| Bazičnost (pKb) | 13,995 | ||
| Konjugirana kislina | hidronij | ||
| Konjugirana baza | hidroksid | ||
| Toplotna prevodnost | 0,6065 W/(m·K)[10] | ||
| Lomni količnik (nD) | 1,3330 (20 °C)[11] | ||
| Viskoznost | 0,890 cP[12] | ||
| Struktura | |||
| Kristalna struktura | Heksagonalna | ||
| C2v | |||
| Oblika molekule | ukrivljena | ||
| Dipolni moment | 1,546 D[13] | ||
| Termokemija | |||
| Specifična toplota, C | 75,385 ± 0,05 J/(mol·K)[14] | ||
| Standardna molarna entropija S |
69,95 ± 0,03 J/(mol·K)[14] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
−285,83 ± 0,04 kJ/mol[4][14] | ||
Gibbsova prosta energija (ΔfG˚)
|
−237,24 kJ/mol[4] | ||
| Nevarnosti | |||
| Glavne nevarnosti | utopitev plaz (kot sneg)
| ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | Negorljivo | ||
| Sorodne snovi | |||
| Drugi kationi | vodikov sulfid vodikov selenid vodikov telurid vodikov polonid vodikov peroksid | ||
| Sorodno topilo | aceton metanol | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Voda ali sistematično oksidan je anorganska spojina s kemijsko formulo H2O. Je skoraj brezbarvna prozorna snov brez vonja in okusa in glavna sestavina Zemljine hidrosfere in tekočin v vseh znanih živih organizmih, v katerih deluje kot topilo.[15] Voda je bistvenega pomena za vse znane oblike življenja, čeprav nima niti kalorij niti organskih hranil.
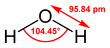
Njena kemijska formula H2O kaže, da njene molekule vsebujejo en kisikov in dva vodikova atoma, povezana s kisikom s kovalentno vezjo. Kot med vodikovima atomoma meri 104,45°.[16] Naziv "voda" se običajno uporablja za vodo v tekočem agregatnem stanju pri standardni temperaturi in tlaku.
Voda ima več agregatnih stanj. V tekočem stanju v ozračju tvori dež in kot aerosol meglo. Oblaki so sestavljeni iz suspendiranih kapljic vode in ledu v njenem trdnem agregatnem stanju. Kristaliziran led lahko pade na zemljo kot sneg. Voda v plinastem agregatnem stanju tvori paro ali vodne hlape.
Voda pokriva približno 70,9 % zemeljske površine, večinoma v morjih in oceanih.[17] Majhen del vode je v podtalnici (1,7 %), ledenikih in ledenih pokrovih Antarktike in Grenlandije (1,7 %), v zraku pa kot para, oblaki, sestavljeni iz ledu in tekoče vode, suspendirane v zraku in padavine (0,001 %).[18][19][20] Voda se nenehno giblje skozi vodni krog izhlapevanja, transpiracije (evapotranspiracije), kondenzacije, padavin in vodotokov, ki običajno dosežejo morje.
Voda igra pomembno vlogo v svetovnem gospodarstvu. Približno 70 % sladke vode, ki jo porabijo ljudje, se porabi v kmetijstvu.[21] Ribolov v slanih in sladkih vodah je glavni vir hrane v številnih delih sveta. Velik del trgovine z blagom na dolge razdalje, kot so nafta, zemeljski plin in industrijski izdelki, se prevaža z ladjami po morjih, rekah, jezerih in kanalih. Velike količine vode, ledu in pare se uporabljajo za hlajenje in ogrevanje v industriji in gospodinjstvih. Voda je odlično topilo za najrazličnejše snovi, tako anorganske kot organske, in se kot taka pogosto uporablja v industrijskih procesih ter pri kuhanju in pranju. Voda, led in sneg so tudi osrednjega pomena za številne športe in druge oblike zabave, kot so plavanje, čolnarjenje, deskanje, športni ribolov, potapljanje, drsanje in smučanje.
- ↑ John Riddick (1970). Organic Solvents Physical Properties and Methods of Purification. Wiley-Interscience. str. 67-68. ISBN 978-0471927266.
- ↑ Hannu Sipola, Pekka Taskinen (julij 2018). "Activity of Supercooled Water on the Ice Curve and Other Thermodynamic Properties of Liquid Water up to the Boiling Point at Standard Pressure". Journal of Chemical & Engineering Data 63 (8). DOI: 10.1021/acs.jced.8b00251. Pridobljeno 20. aprila 2022.
- ↑ Water in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (pridobljeno 2016-5-27)
- ↑ 4,0 4,1 4,2 Anatolievich, Kiper Ruslan. »Properties of substance: water«. Arhivirano iz prvotnega spletišča dne 2. junija 2014. Pridobljeno 18. aprila 2022.
- ↑ David R. Lide (ur.). CRC Handbook of Chemistry and Physics. 85. izdaja. Internet-Version: 2005. CRC Press/Taylor and Francis. Boca Raton, FL. Fluid Properties, str. 6-3 – 6-5.
- ↑ Lide 2003, Chapter 8: Dissociation Constants of Inorganic Acids and Bases.
- ↑ Weingärtner, Hermann; Franck, Ernst Ulrich (25. april 2005). »Supercritical Water as a Solvent«. Angewandte Chemie International Edition. Zv. 44, št. 18. str. 2672–2692. doi:10.1002/anie.200462468.
- ↑ »What is the pKa of Water«. Univerza Kalifornije, Davis. 9. avgust 2015.
- ↑ Silverstein, Todd P.; Heller, Stephen T. (17. april 2017). »pKa Values in the Undergraduate Curriculum: What Is the Real pKa of Water?«. Journal of Chemical Education. Zv. 94, št. 6. str. 690–695. Bibcode:2017JChEd..94..690S. doi:10.1021/acs.jchemed.6b00623.
- ↑ Ramires, Maria L. V.; Castro, Carlos A. Nieto de; Nagasaka, Yuchi; Nagashima, Akira; Assael, Marc J.; Wakeham, William A. (1. maj 1995). »Standard Reference Data for the Thermal Conductivity of Water«. Journal of Physical and Chemical Reference Data. Zv. 24, št. 3. str. 1377–1381. Bibcode:1995JPCRD..24.1377R. doi:10.1063/1.555963. ISSN 0047-2689.
- ↑ Lide 2003, 8—Concentrative Properties of Aqueous Solutions: Density, Refractive Index, Freezing Point Depression, and Viscosity.
- ↑ Lide 2003, 6.186.
- ↑ Lide 2003, 9—Dipole Moments.
- ↑ 14,0 14,1 14,2 Water in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (pridobljeno 2014-06-01)
- ↑ »Water Q&A: Why is water the »universal solvent«?«. United States Geological Survey. Pridobljeno 15. januarja 2021.
- ↑ »10.2: Hybrid Orbitals in Water«. Chemistry LibreTexts (v angleščini). 18. marec 2020. Pridobljeno 11. aprila 2021.
- ↑ »CIA – THE WORLD FACTBOOK Geography Geographic overview«. Centralna obveščevalna agencija. Pridobljeno 20. decembra 2008.
- ↑ Gleick, P.H., ur. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. str. 13. Arhivirano iz prvotnega spletišča dne 8. aprila 2013.
- ↑ Water Vapor in the Climate System : Special report. Ameriško geofizikalno združenje. december 1995. Arhivirano iz prvotnega spletišča dne 2007-03-28. https://web.archive.org/web/20070320034158/http://www.agu.org/sci_soc/mockler.html.
- ↑ »Vital Water«. UNEP. Arhivirano iz prvotnega spletišča dne 20. februarja 2008.
- ↑ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). »Evaluating the environmental impact of various dietary patterns combined with different food production systems«. European Journal of Clinical Nutrition. Zv. 61, št. 2. str. 279–286. doi:10.1038/sj.ejcn.1602522. PMID 17035955.
Napaka pri navajanju: Obstajajo <ref group=lower-alpha> oznake ali predloge {{efn}} na tej strani, toda sklici se ne bodo izpisali brez predloge {{sklici|group=lower-alpha}} ali predloge {{notelist}} (glej stran pomoči).