
Back Triptofaan Afrikaans تريبتوفان Arabic Triptofan Azerbaijani تریپتوفان AZB Трыптафан Byelorussian Трыптафан BE-X-OLD Триптофан Bulgarian ট্রিপ্টোফ্যান Bengali/Bangla Triptofan BS Triptòfan Catalan
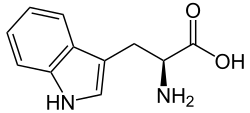

Tryptofan (förkortas Trp eller W) är inom biokemi en av de 20 aminosyror som är byggstenar i proteiner. Den tillhör gruppen opolära, hydrofoba aminosyror och är en av de essentiella aminosyrorna,[1] som kroppen inte själv kan tillverka, och som därför måste tillföras i födan. Bara L-stereoisomeren av tryptofan används som strukturellt enzymprotein; D-stereoisomeren är vanligast förekommande i naturligt producerade peptider. Det utmärkande strukturella kännetecknet för tryptofan är att den har en indol-grupp. Den är en av de två aminosyror som motsvaras av endast ett kodon (UGG) i den genetiska koden.
Tryptofan är också ett utgångsämne (substrat) vid kroppens tillverkning av serotonin[2] och melatonin som har betydelse för sömn, avslappning och stämningsläge och även blodkärlssammandragande. Tryptofan kan även användas för bildning av niacin.[3] I mat finns tryptofan i proteinrik föda, främst i kött och hårdost men även i mjölk och spannmål (se havregryn). Vissa nötter och frön har en hög halt av tryptofan; särskilt kan nämnas pumpafrökärnor och chiafrön. Kynurenin bildas i omsättningen av tryptofan.
Hos växter, svampar och bakterier är tryptofan substrat för biosyntesen av indolättiksyra.
- ^ ”Nationalencyklopedin, essentiella aminosyror”. Nationalencyklopedin. http://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/essentiella-aminosyror. Läst 21 juli 2017.
- ^ ”Kopplingen mellan autism, D-vitamin och serotonin”. www.nordicnutritioncouncil.com. Arkiverad från originalet den 8 september 2017. https://web.archive.org/web/20170908024028/http://www.nordicnutritioncouncil.com/kopplingen-mellan-autism-d-vitamin-och-serotonin/. Läst 21 juli 2017.
- ^ ”Niacin”. www.livsmedelsverket.se. https://www.livsmedelsverket.se/livsmedel-och-innehall/naringsamne/vitaminer-och-antioxidanter/niacin. Läst 21 juli 2017.